Gabriela Feix Pereira* 1, 2, Taiah Rajeh Rosin 2, Bibiana Braga ², Gertrudes Corção1
1 ICBS, Departamento de Microbiologia, UFRGS, Porto Alegre – RS ² Dorf Ketal, Centro de Pesquisa, Desenvolvimento e Inovação, Nova Santa Rita – RS
Resumo
O controle microbiano em campos de petróleo pode ser considerado um assunto complexo, uma vez que a diversidade do microbioma e as características físico-químicas da água produzida (AP) originam um perfil único. Biocidas são usados como tratamento microbiológico, mas a toxicidade relacionada aos grandes volumes utilizados pode causar problemas ambientais. A eficiência de biocidas e, consequentemente, a redução do impacto ambiental, podem ser melhoradas por meio de um planejamento adequado. Mediante informações de literatura relacionadas aos biocidas, aos microrganismos presentes em AP e seus mecanismos de resistência, este artigo sugere uma abordagem de cinco etapas para tratamentos microbiológicos: 1) determinação dos objetivos; 2) bioauditoria; 3) seleção do(s) biocida(s) em laboratório; 4) seleção de indicadores-chave de desempenho (KPI) viáveis e representativos; e 5) monitoramento do tratamento. Finalmente, este artigo apresenta resultados de um estudo de caso visando a otimização de um tratamento microbiológico aplicando a abordagem de cinco etapas. Os resultados mostraram redução de aproximadamente 50% na dosagem do biocida e proteção do sistema por 14 dias, em comparação a 2 dias de proteção do tratamento anterior.
Introdução
A água produzida (AP) é o principal resíduo aquoso gerado em campos de petróleo e o aumento da produção de petróleo ao longo dos anos levou à geração de volumes ainda maiores (AL-GHOUTI et al., 2019). O volume de AP gerado está diretamente relacionado à idade do reservatório de petróleo e ao método de extração utilizado. Em poços maduros, o volume de AP pode chegar a nove vezes o volume de petróleo extraído. Além disso, durante o processo de extração secundária de petróleo, através da injeção de água do mar o volume gerado de AP tende a ser ainda maior (JIMÉNEZ et al., 2018).
O processo de manejo da AP é um ponto crítico, uma vez que sua composição físico-química variável e as condições de processamento e armazenamento impulsionam o desenvolvimento de microrganismos. Procariotos redutores de sulfato (PRS) e bactérias produtoras de ácido (BPA) são onipresentes neste ambiente, e estão associadas a diversos problemas, como deficiências na integridade das instalações e questões de saúde e segurança dos trabalhadores. O grupo PRS é conhecido principalmente pela produção de sulfeto de hidrogênio (H2S), um gás corrosivo e tóxico (MUYZER; STAMS, 2008). Além disso, a liberação de metabólitos altamente corrosivos por BPA, também contribui para o aumento da biocorrosão (MARCIALES et al., 2019). Além dos papéis únicos de PRS e BPA, já foram relatadas interações sintróficas entre ambos os grupos (XU; LI; GU, 2016; DAWUDA; TALEB-BERROUANE; KHAN, 2021).
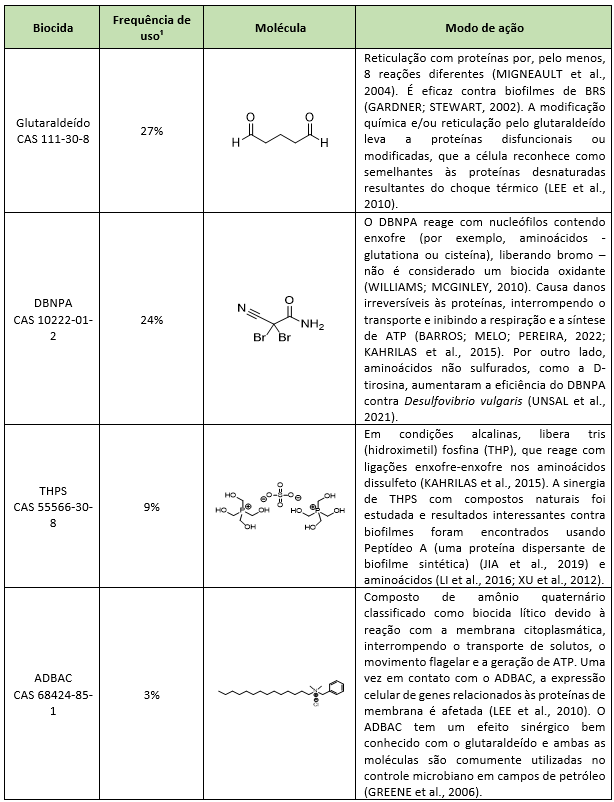
O uso de biocidas é fortemente sugerido como ferramenta de mitigação e prevenção de problemas microbiológicos. Os biocidas mais utilizados mundialmente na indústria de petróleo são glutaraldeído, 2,2-dibromo-3-nitrilopropionamida (DBNPA), sulfato de tetraquis(hidroximetil)fosfônio (THPS) e cloreto de alquil dimetil benzil amônio (ADBAC) (KAHRILAS et al., 2015). Porém, tratamentos microbiológicos inadequadamente planejados podem desencadear resistência microbiana, diminuindo consideravelmente a eficácia do tratamento e causando aumento de danos ambientais, devido ao aumento da dosagem do biocida impulsionado pela perda da eficiência.
Para o planejamento adequado do tratamento microbiológico deve-se considerar as variáveis físico-químicas e microbiológicas do sistema. Neste artigo, o impacto destas variáveis no tratamento é reduzido a partir da aplicação de cinco etapas durante o planejamento: 1) objetivos bem definidos; 2) bioauditoria para uma visão integrada do sistema; 3) seleção de biocida(s) adequado(s) em laboratório, considerando as condições do processo e a suscetibilidade dos alvos microbianos; 4) seleção de KPI viáveis e representativos; e 5) monitoramento do tratamento. Por fim, este artigo demonstra estudo de caso utilizando esta abordagem de cinco etapas.
Composição microbiológica da AP
A geologia dos reservatórios e os processos de separação do petróleo determinam as características físico-químicas da AP e essas características selecionam os microrganismos mais adaptados. Em geral, devido às condições extremas, o microbioma de campos de petróleo é composto predominantemente por bactérias, embora a presença de archaea também seja relatada com frequência (SIERRA-GARCIA et al., 2017; HIDALGO et al., 2021).
Devido ao impacto negativo na cadeia de petróleo, alguns grupos microbianos são mais estudados do que outros. PRS, principalmente as bactérias redutoras de sulfato (BRS), o grupo mais estudado, estão diretamente relacionados à geração biológica de sulfeto de hidrogênio (H2S) e têm sido associados à biocorrosão tipo I (JIA et al., 2019a; RAJBONGSHI; GOGOI, 2021). Já o grupo das BPA, também denominadas bactérias fermentativas, liberam subprodutos de metabolismo corrosivos que podem aumentar a biocorrosão tipo II (JIA et al., 2019a; MARCIALES et al., 2019). Além do papel individual de BRS e BPA, interações sintróficas, onde BRS utilizam subprodutos de metabolismo de BPA (por exemplo, lactato e acetato) como fonte de carbono, já foram relatadas. Ao final, essas interações sintróficas conferem robustez à estrutura de biofilmes. Além da relação sintrófica, outra variável durante a formação de biofilmes é a tolerância ao oxigênio. As BRS, anaeróbias estritas, se depositam na base do biofilme, e devido às relações sintróficas entre os grupos, as BPA se depositam em camadas superiores, uma vez que são mais tolerantes ao oxigênio. Essas estruturas heterogêneas geram focos de biocorrosão dinâmicos, que misturam mecanismos tanto do tipo I (devido à ação das BRS), quanto do tipo II (devido à ação das BPA), dificultando seu controle. Além disso, biofilmes espessos e heterogêneos dificultam a penetração do biocida, exigindo em média uma concentração de biocida dez vezes maior para a mitigação, em comparação às bactérias planctônicas (de vida livre) (XU; LI; GU, 2016).
Embora menos relatados, outros grupos microbianos desempenham um papel nos processos de biocorrosão e deterioração do petróleo, como arqueas metanogênicas e bactérias redutoras de nitrato (BRN) (LAHME et al., 2019; JI et al., 2020). Arqueas metanogênicas desempenham um papel importante na biodegradação de hidrocarbonetos devido à sua capacidade de oxidar o hidrogênio no petróleo bruto e outros componentes como n-alcanos, benzeno, tolueno e hidrocarbonetos aromáticos policíclicos (RAJBONGSHI; GOGOI, 2021). BRN reduzem o nitrato a nitrito e podem remover o sulfeto existente ou inibir a produção de sulfeto na AP por BRS (RAJBONGSHI; GOGOI, 2021).
Resistência bacteriana a biocidas
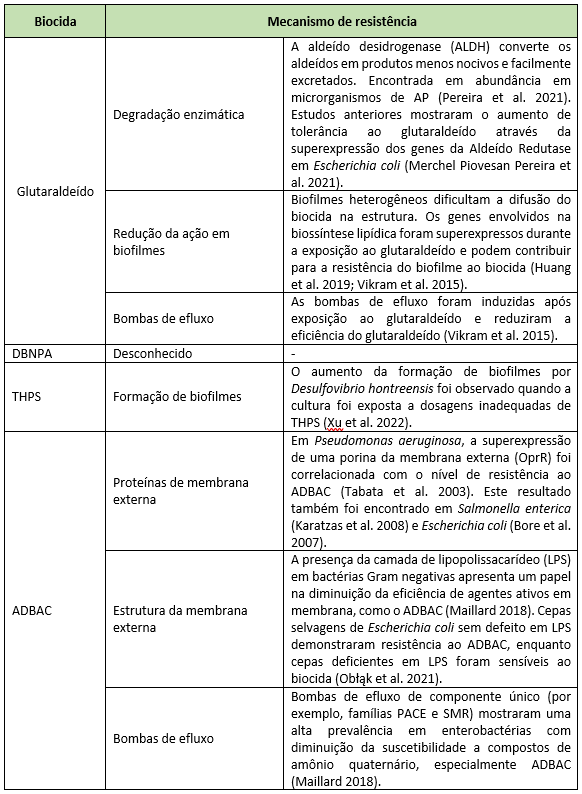
A forma mais comum de mitigar problemas microbianos em campos petrolíferos é a aplicação de biocidas. Os biocidas padrão usados mundialmente em AP, seus modos de ação e frequência de uso, estão descritos na Tabela 1. Já os mecanismos de resistência bacteriana descritos para esses biocidas padrão são mostrados na Tabela 2. Biocidas usados quase exclusivamente em campos de petróleo (ou seja, THPS e DBNPA) não apresentaram modo de ação e mecanismos de resistência completamente elucidados em razão da falta de literatura disponível. Por outro lado, biocidas comumente aplicados nas áreas de saúde e alimentos apresentaram alta densidade de informações.
Dentre os principais mecanismos de resistência descritos para biocidas estão as bombas de efluxo e a formação de biofilmes. As bombas de efluxo são responsáveis por reduzir a concentração de moléculas tóxicas no interior da célula bacteriana. As famílias de bombas de efluxo AcrAB – TolC e MATE estão amplamente disseminadas entre espécies de bactérias e podem conferir suscetibilidade reduzida a uma ampla variedade de biocidas, como compostos de amônio quaternário e glutaraldeído. O aumento na expressão dos genes relacionados às bombas de efluxo tem sido identificado durante a exposição a biocidas, respaldando o papel desse importante mecanismo de resistência em bactérias (MORENTE et al., 2013; BEDOYA et al., 2021). Além das bombas de efluxo, a formação de biofilmes também é um importante mecanismo de resistência, principalmente nos campos de petróleo. Os campos de petróleo são ambientes altamente estressantes, com nutrientes limitados, pH e temperaturas extremos. Estas condições, aliadas à presença de biocidas, podem desencadear respostas morfológicas na população bacteriana que aderem imediatamente a uma superfície como estratégia de sobrevivência. Após a fase de adesão do biofilme, a fase de crescimento pode ocorrer em tubulações com baixas vazões ou tanques de armazenamento, onde tanto a água quanto os sólidos em suspensão se depositam no fundo criando condições em que bactérias sésseis são expostas a ciclos intermitentes de presença e esgotamento de nutrientes, resultando em biofilmes espessos (JENNEMAN; DE LEΌN, 2022).
Tratamento da AP com biocidas
O uso de biocidas para controlar o crescimento bacteriano em campos de petróleo não tem sido seriamente considerado. Um tratamento biocida inadequado pode contribuir para o aumento da pressão seletiva e, consequentemente, da resistência bacteriana (CAMPA et al., 2019). Com isso, o cenário ideal seria o estabelecimento de tratamentos mais específicos e mais bem planejados.
Um caso de implementação de tratamento biocida considerando condições físico-químicas e microbiológicas foi descrito anteriormente. Amostras de quatro campos petrolíferos diferentes (dois brasileiros e dois argentinos) que apresentavam problemas de resistência ao tratamento atual (THPS em dosagem contínua) foram avaliadas em laboratório utilizando técnicas moleculares e dependentes de cultura. As avaliações laboratoriais demonstram a combinação mais eficiente de biocidas e o benefício da mudança no esquema de aplicação, indicando aplicação em batelada em vez de aplicação contínua. O monitoramento foi realizado através da concentração de bactérias anaeróbias totais e como resultado, após o primeiro mês, todos os quatro campos de petróleo atingiram uma redução de 6 logs da concentração bacteriana (PASCHOALINO et al., 2019). Os resultados descritos neste estudo fornecem embasamento para a abordagem de cinco etapas descrita detalhadamente neste tópico.
Etapa 1 – Objetivos do tratamento
Diversas razões podem explicar a aplicação de biocidas em AP, por exemplo o controle da biocorrosão, a redução de H2S, a limpeza de tanques e tubulações, a inibição ou erradicação de biofilmes em filtros. Com isso, antes do início do tratamento, é importante elencar os problemas que podem ser resolvidos com a aplicação do biocida e os principais alvos microbianos, a fim de delinear os objetivos do tratamento. Apesar do amplo espectro de ação dos biocidas em geral, a suscetibilidade dos microrganismos é variável (PEREIRA; PILZ-JUNIOR; CORÇÃO, 2021) e a aplicação do biocida dificilmente irá atingir na mesma magnitude todos os grupos presentes na AP, portanto, destaca-se a importância da definição do objetivo principal do tratamento e dos alvos microbianos.
Etapa 2 – Bioauditoria
A etapa de bioauditoria visa investigar a presença de microrganismos ao longo do processo e encontrar os pontos críticos de contaminação. Durante a avaliação, os pontos do processo com maiores concentrações são identificados e considerados como candidatos à injeção do biocida.
A bioauditoria consiste na varredura do processo através da utilização de ferramentas microbiológicas com abordagens moleculares, enzimáticas ou dependentes de cultura (PASCHOALINO, 2021). Análises baseadas em técnicas dependentes de cultura são as mais utilizadas e recomendadas por normas da área para determinar a concentração bacteriana. A norma NACE TM0194-2014 – Field Monitoring of Bacterial Growth in Oil and Gas Systems, por exemplo, descreve o método e o meio de cultura para enumeração de BRS e outros grupos bacterianos. A norma API-RP-38 – Recommended Practice for Biological Analysis of Subsurface Injection Waters, também recomenda diferentes meios de cultura para a enumeração bactérias.
Na prática, pode ser necessária a complementação dessas análises com métodos moleculares, independentes de cultura, pois sabe-se que pelo menos 90% dos microrganismos encontrados em campos de petróleo não são cultiváveis (SKOVHUS; WHITBY, 2019). Um estudo avaliou pela técnica 16S rRNA a composição microbiana de uma amostra de água de injeção e do consórcio bacteriano crescido em meio de cultura originado desta amostra. Os resultados obtidos no estudo mostraram que a dinâmica da população microbiana mudou em ambos os casos, afetando as respostas aos biocidas (ROMERO et al., 2005).
Apesar das desvantagens em termos de custo, a utilização de métodos moleculares pode ser crucial na definição dos alvos do tratamento biocida. Diversos estudos relatam o uso do sequenciamento do gene 16S rRNA para avaliar a diversidade do microbioma em campos de petróleo (KEASLER et al., 2013; LI et al., 2017; HIDALGO et al., 2021). Outra ferramenta molecular importante nesta área de estudo é a técnica Real Time PCR (RTPCR), que utiliza primers para quantificar genes específicos e correlacioná-los com os microrganismos presentes na amostra. Com esta mesma ferramenta também pode ser avaliada a expressão de genes de resistência, que podem afetar a eficácia do tratamento microbiológico (CAMPA et al., 2019).
Ferramentas enzimáticas também podem ser utilizadas na etapa de bioauditoria. A quantificação de ATP fornece dados sobre a concentração total de células viáveis na amostra (HAMMES et al., 2010). Embora não seja indicada como ferramenta única devido ao amplo escopo da resposta, considerando não apenas microrganismos, mas qualquer célula viável presente na amostra, pode ser utilizada como técnica complementar.
Etapa 3 – Screening dos biocidas em laboratório
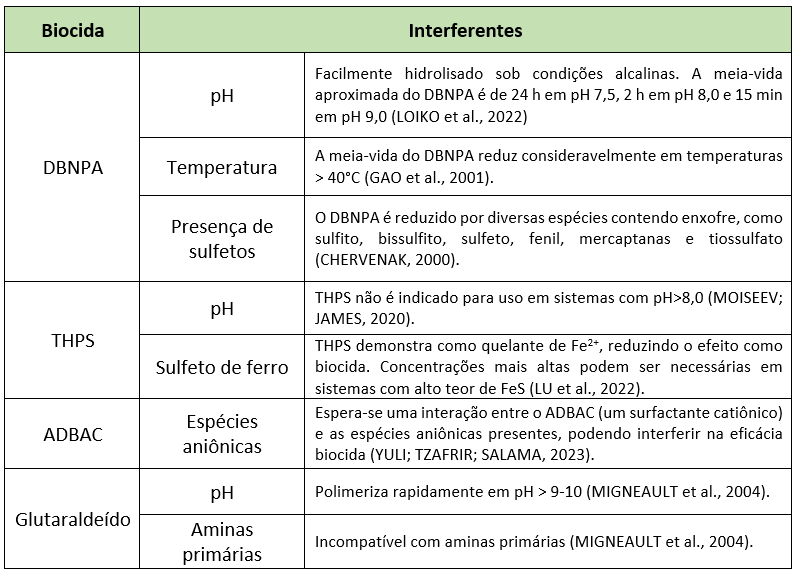
Além da composição microbiológica, os dados físico-químicos dos pontos de injeção candidatos também precisam ser considerados antes da triagem dos biocidas, uma vez que a estabilidade química dos biocidas sintéticos pode ser prejudicada pelas condições como pH, temperatura e presença de produtos químicos reativos (Williams e Schultz 2015). A Tabela 3 mostra os principais interferentes conhecidos na estabilidade química dos biocidas. Considerando a estabilidade química, esta etapa visa encontrar os biocidas mais eficientes nas condições do sistema.
Os métodos padrão mencionados na etapa 2 (item 3.2.) também podem ser utilizados na etapa de screening para determinar a suscetibilidade bactérias planctônicas a biocidas. Para avaliação de eficiência de biocidas em biofilmes, a norma NACE TM21495 – Laboratory Evaluation of the Effect of Biocides on Biofilms aborda protocolos de avaliação laboratorial baseados em meio de cultura (WADE et al., 2023). Além disso, os biofilmes podem ser avaliados através do crescimento em microplacas de 96 poços e lidos por espectrofotometria (STEPANOVIĆ et al., 2007), ou sob cupons metálicos e quantificação por Número Mais Provável (NMP) (JIA et al., 2017; WANG e outros, 2022).
Etapa 4 – Seleção de Indicadores Chave de Performance (KPI)
KPI são usados para quantificar a eficácia do tratamento microbiológico (JOHNSON, 2017; KEASLER et al., 2017), e seu uso apropriado é uma das chaves para um tratamento eficaz (JIANG et al., 2021). A seleção do KPI depende dos objetivos definidos para o tratamento (etapa 1; item 3.1.), dos alvos microbianos (etapa 2; item 3.2.) e dos biocidas selecionados (etapa 3; item 3.3.). Este estudo classificou os KPI em abordagens diretas e indiretas. Os KPI diretos referem-se diretamente a dados relacionados ao crescimento microbiano e aos biocidas. Exemplos de KPI direto são a concentração de células planctônicas ou sésseis nos sistemas e o conteúdo residual de biocida. Os KPI indiretos estão relacionados à integridade do sistema e dados físico-químicos, por exemplo, taxas de corrosão, teor de H2S, pressão em tubulações e filtros de água.
Etapa 5 – Monitoramento do tratamento
É indispensável que as ferramentas selecionadas para o monitoramento dos KPI sejam ferramentas viáveis de serem utilizadas em campos de petróleo, considerando a estrutura disponível. O monitoramento dos KPI selecionados apoia a tomada de decisões relacionada ao tratamento (JOHNSON, 2017). Os métodos para o monitoramento de KPI diretos podem ser desde técnicas dependentes de cultura até técnicas moleculares (PASCHOALINO, 2021), exemplos foram descritos na etapa 2 (item 3.2.). Quanto aos KPI indiretos, o teor de H2S pode ser monitorado através de métodos de titulação (NASSER et al., 2021), e as taxas de corrosão podem ser monitoradas por cupons metálicos instalados ao longo do sistema, sondas de resistência elétrica, instrumentos de polarização linear ou métodos equivalentes (AL -JANABI, 2020). Além disso, dados de acompanhamento do processo, como pressão, vazão e outros, podem ser utilizados como KPI.
Estudo de caso
Além da otimização do tratamento microbiológico descrita por Paschoalino et al. 2019 em campos onshore, a otimização de um tratamento biocida em uma plataforma offshore brasileira foi realizada pela Dorf Ketal Brasil Ltda. A plataforma estava localizada na camada Pré-Sal da Bacia de Santos, em lâmina d’água de cerca de 2.240 m.
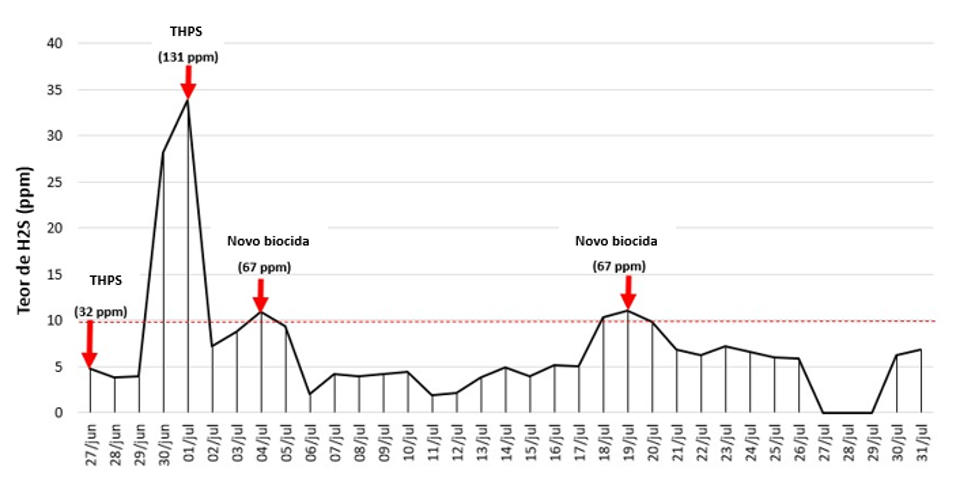
Antes da otimização, o biocida THPS era aplicado em slop tank duas vezes por semana a uma concentração de aproximadamente 130 ppm por batelada. O tanque apresentava uma espessa camada de óleo na superfície, o que dificultava a passagem do THPS para a água. Além disso, devido à rápida degradação da molécula, não foi observada eficiência a longo prazo, resultando na necessidade de aumento da frequência de aplicação.
O principal objetivo da aplicação de um tratamento microbiológico em slop tank era controlar a geração de H2S, e o objetivo da otimização do tratamento era reduzir a frequência de aplicação do biocida. Como alvo microbiano, estabeleceu-se as BRS por conta do seu papel na geração de H2S. Amostras de água do tanque foram enviadas ao laboratório Dorf Ketal e com base no histórico de resistência ao THPS, no alvo microbiano e nas condições físico-químicas da água, foi desenvolvido um biocida customizado.
Após o desenvolvimento em laboratório, foi realizado um ensaio de campo para definição da concentração do biocida e da frequência de aplicação no slop tank (Fig. 1). A concentração de H2S na água foi utilizada como um KPI indireto para monitoramento, e o limite aceitável de concentração de H2S era de 10 ppm. Além do monitoramento pelo teor de H2S, a concentração de ATP foi utilizada como um KPI direto.
Como resultado, a otimização resultou em um controle de H2S de 14 dias com metade da concentração (67 ppm) em comparação com o THPS usado anteriormente (131 ppm). A eficiência no controle microbiano, quantificada pela concentração de ATP, atingiu 89% com tratamento otimizado (dados não mostrados).
Conclusões
Com foco na otimização do controle microbiano e na redução da interferência de variáveis físico-químicas e microbiológicas, este artigo sugere uma abordagem em cinco etapas para tratamentos microbiológicos. Os objetivos do tratamento devem ser claros antes do planejamento, e uma bioauditoria é desejável para compreender a composição do microbioma e selecionar alvos microbianos precisos. Depois de selecionar os alvos microbianos, uma triagem de biocidas em laboratório pode demonstrar quais biocidas são adequados considerando a sua eficiência e estabilidade química. Finalmente, KPI representativos de acordo com os objetivos do tratamento podem ser monitorados através de diversas técnicas descritas neste artigo. Em um estudo de caso, a utilização da abordagem de cinco etapas resultou na redução da frequência de aplicação de um biocida em slop tank de uma plataforma localizada no Pré-Sal brasileiro. A otimização resultou em um controle de H2S de 14 dias utilizando o tratamento customizado, através da aplicação de uma dosagem 50% menor em comparação ao biocida utilizado anteriormente (THPS).
Referências
ABBAS, R. H.; HERNANDEZ, J. F.; AL ABBAS, F. M. Holding Water — A Corrosion Management Program in a Vast Seawater Injection SystemCORROSION 2020, 14 jun. 2020. .
AL-GHOUTI, M. A. et al. Produced water characteristics, treatment and reuse: A reviewJournal of Water Process Engineering, 2019. .
AL-JANABI, Y. T. An overview of corrosion in oil and gas industry: upstream, midstream, and downstream sectors. Corrosion Inhibitors in the Oil and Gas Industry, p. 1–39, 2020.
BARROS, A. C.; MELO, L. F.; PEREIRA, A. A Multi-Purpose Approach to the Mechanisms of Action of Two Biocides (Benzalkonium Chloride and Dibromonitrilopropionamide): Discussion of Pseudomonas fluorescens’ Viability and Death. Frontiers in Microbiology, v. 13, p. 842414, 2022.
BEDOYA, K. et al. Assessment of the microbial community and biocide resistance profile in production and injection waters from an Andean oil reservoir in Colombia. International Biodeterioration & Biodegradation, v. 157, p. 105137, 2021. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830520310684>.
BORE, E. et al. Adapted tolerance to benzalkonium chloride in Escherichia coli K-12 studied by transcriptome and proteome analyses. Microbiology, v. 153, n. 4, p. 935–946, 2007.
CAMPA, M. F. et al. Unconventional oil and gas energy systems: an unidentified hotspot of antimicrobial resistance? Frontiers in microbiology, v. 10, p. 2392, 2019.
CHERVENAK, M. C. The environmental fate of commonly used oxidizing and non-oxidizing biocides: reactions of industrial water biocides within the system. In: Int Environ Conf Exhibit, Anais…Citeseer, 2000.
DAWUDA, A.-W.; TALEB-BERROUANE, M.; KHAN, F. A probabilistic model to estimate microbiologically influenced corrosion rate. Process Safety and Environmental Protection, v. 148, p. 908–926, 2021.
EL-AZIZI, M.; FARAG, N.; KHARDORI, N. Efficacy of selected biocides in the decontamination of common nosocomial bacterial pathogens in biofilm and planktonic forms. Comparative immunology, microbiology and infectious diseases, v. 47, p. 60–71, 2016.
GAO, Y. et al. Efficacy of DBNPA against Legionella pneumophila: experimental results in a model water system. ASHRAE Transactions, v. 107, p. 184, 2001.
GARDNER, L. R.; STEWART, P. S. Action of glutaraldehyde and nitrite against sulfate-reducing bacterial biofilms. Journal of Industrial Microbiology and Biotechnology, v. 29, n. 6, p. 354–360, 1 dez. 2002. Disponível em: <https://doi.org/10.1038/sj.jim.7000284>.
GREENE, E. A. et al. Synergistic inhibition of microbial sulfide production by combinations of the metabolic inhibitor nitrite and biocides. Applied and Environmental Microbiology, 2006.
HIDALGO, K. J. et al. Genome-Resolved Meta-Analysis of the Microbiome in Oil Reservoirs WorldwideMicroorganisms , 2021. .
HUANG, L. et al. Role of LptD in Resistance to Glutaraldehyde and Pathogenicity in Riemerella anatipestifer Frontiers in Microbiology , 2019. . Disponível em: <https://www.frontiersin.org/article/10.3389/fmicb.2019.01443>.
JENNEMAN, G. E.; DE LEΌN, K. B. Environmental stressors alter the susceptibility of microorganisms to biocides in upstream oil and gas systems. International Biodeterioration & Biodegradation, v. 169, p. 105385, 2022.
JI, J.-H. et al. Methanogenic biodegradation of C13 and C14 n-alkanes activated by addition to fumarate. International Biodeterioration & Biodegradation, v. 153, p. 104994, 2020.
JIA, R. et al. Laboratory testing of enhanced biocide mitigation of an oilfield biofilm and its microbiologically influenced corrosion of carbon steel in the presence of oilfield chemicals. International Biodeterioration & Biodegradation, v. 125, p. 116–124, 2017. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830517308508>.
JIA, R. et al. Microbiologically influenced corrosion and current mitigation strategies: A state of the art reviewInternational Biodeterioration and Biodegradation, 2019a. .
JIA, R. et al. A sea anemone-inspired small synthetic peptide at sub-ppm concentrations enhanced biofilm mitigation. International Biodeterioration & Biodegradation, v. 139, p. 78–85, 2019b. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830518307637>.
JIANG, W. et al. A critical review of analytical methods for comprehensive characterization of produced water. Water, v. 13, n. 2, p. 183, 2021.
JIMÉNEZ, S. et al. State of the art of produced water treatmentChemosphere, 2018. .
JOHNSON, R. J. Combining Advanced Biocide Evaluation and Microbial Monitoring to Optimise Microbial Control. In: SPE International Conference on Oilfield Chemistry, Anais…OnePetro, 2017.
KAHRILAS, G. A. et al. Biocides in Hydraulic Fracturing Fluids: A Critical Review of Their Usage, Mobility, Degradation, and Toxicity. Environmental Science & Technology, v. 49, n. 1, p. 16–32, 6 jan. 2015. Disponível em: <https://doi.org/10.1021/es503724k>.
KARATZAS, K. A. G. et al. Phenotypic and proteomic characterization of multiply antibiotic-resistant variants of Salmonella enterica serovar Typhimurium selected following exposure to disinfectants. Applied and environmental microbiology, v. 74, n. 5, p. 1508–1516, 2008.
KEASLER, V. et al. Expanding the microbial monitoring toolkit: Evaluation of traditional and molecular monitoring methods. International Biodeterioration & Biodegradation, v. 81, p. 51–56, 2013.
KEASLER, V. et al. Biocides overview and applications in petroleum microbiology. Trends in oil and gas corrosion research and technologies, p. 539–562, 2017.
LAHME, S. et al. Metabolites of an oil field sulfide-oxidizing, nitrate-reducing Sulfurimonas sp. cause severe corrosion. Applied and environmental microbiology, v. 85, n. 3, p. e01891-18, 2019.
LEE, M. H. P. et al. Effects of biocides on gene expression in the sulfate-reducing bacterium Desulfovibrio vulgaris Hildenborough. Applied Microbiology and Biotechnology, 2010.
LI, X.-X. et al. Microbiota and their affiliation with physiochemical characteristics of different subsurface petroleum reservoirs. International Biodeterioration & Biodegradation, v. 120, p. 170–185, 2017.
LI, Y. et al. Enhanced biocide mitigation of field biofilm consortia by a mixture of D-amino acids. Frontiers in microbiology, v. 7, p. 896, 2016.
LOIKO, N. et al. Biocides with Controlled Degradation for Environmentally Friendly and Cost-Effective Fecal Sludge Management. Biology, v. 12, n. 1, p. 45, 2022.
LU, H. et al. FeS Scale Control and Prevention in Water Injection Systems. In: SPE International Oilfield Scale Conference and Exhibition, Anais…OnePetro, 2022.
MAILLARD, J.-Y. Resistance of bacteria to biocides. Microbiology spectrum, v. 6, n. 2, p. 2–6, 2018.
MARCIALES, A. et al. Mechanistic microbiologically influenced corrosion modeling—A reviewCorrosion Science, 2019. .
MERCHEL PIOVESAN PEREIRA, B. et al. Tolerance to Glutaraldehyde in Escherichia coli Mediated by Overexpression of the Aldehyde Reductase YqhD by YqhC Frontiers in Microbiology , 2021. . Disponível em: <https://www.frontiersin.org/article/10.3389/fmicb.2021.680553>.
MIGNEAULT, I. et al. Glutaraldehyde: behavior in aqueous solution, reaction with proteins, and application to enzyme crosslinking. Biotechniques, v. 37, n. 5, p. 790–802, 2004.
MOISEEV, D. V; JAMES, B. R. Tetrakis (hydroxymethyl) phosphonium salts: Their properties, hazards and toxicities. Phosphorus, Sulfur, and Silicon and the Related Elements, v. 195, n. 4, p. 263–279, 2020.
MORENTE, E. O. et al. Biocide tolerance in bacteria. International journal of food microbiology, v. 162, n. 1, p. 13–25, 2013.
MUYZER, G.; STAMS, A. J. M. The ecology and biotechnology of sulphate-reducing bacteriaNature Reviews Microbiology, 2008. .
NASSER, B. et al. Characterization of microbiologically influenced corrosion by comprehensive metagenomic analysis of an inland oil field. Gene, v. 774, p. 145425, 2021.
OBŁĄK, E.; FUTOMA-KOŁOCH, B.; WIECZYŃSKA, A. Biological activity of quaternary ammonium salts and resistance of microorganisms to these compounds. World Journal of Microbiology and Biotechnology, v. 37, n. 2, p. 22, 2021. Disponível em: <https://doi.org/10.1007/s11274-020-02978-0>.
PAIJENS, C. et al. Determination of 18 biocides in both the dissolved and particulate fractions of urban and surface waters by HPLC-MS/MS. Water, Air, & Soil Pollution, v. 231, n. 5, p. 210, 2020.
PASCHOALINO, M. et al. Evaluation of a glutaraldehyde/THNM combination for microbial control in four conventional oilfields. In: SPE International Conference on Oilfield Chemistry, Anais…OnePetro, 2019.
PASCHOALINO, M. Influence of Chemical Treatments and Topside Processes on the Dominant Microbial Communities at Conventional Oilfields. In: Microbial Bioinformatics in the Oil and Gas Industry. [s.l.] CRC Press, 2021. p. 81–97.
PEREIRA, G. F.; PILZ-JUNIOR, H. L.; CORÇÃO, G. The impact of bacterial diversity on resistance to biocides in oilfields. Scientific reports, v. 11, n. 1, p. 1–12, 2021.
RAJBONGSHI, A.; GOGOI, S. B. A review on anaerobic microorganisms isolated from oil reservoirs. World Journal of Microbiology and Biotechnology, v. 37, n. 7, p. 1–19, 2021.
ROMERO, J. M. et al. Genetic Monitoring of Bacterial Populations in a Sea Water Injection System, Identification of Biocide Resistant Bacteria and Study of their Corrosive Effect. In: CORROSION 2005, Anais…OnePetro, 2005.
SAUER, K. et al. Neutral super-oxidised solutions are effective in killing P. aeruginosa biofilms. Biofouling, v. 25, n. 1, p. 45–54, 2009.
SIERRA-GARCIA, I. N. et al. Microbial diversity in degraded and non-degraded petroleum samples and comparison across oil reservoirs at local and global scales. Extremophiles, v. 21, n. 1, p. 211–229, 2017.
SKOVHUS, T. L.; WHITBY, C. Oilfield Microbiology. [s.l.] CRC Press, 2019.
STEPANOVIĆ, S. et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci. Apmis, v. 115, n. 8, p. 891–899, 2007.
TABATA, A. et al. Correlation between resistance of Pseudomonas aeruginosa to quaternary ammonium compounds and expression of outer membrane protein OprR. Antimicrobial agents and chemotherapy, v. 47, n. 7, p. 2093–2099, 2003.
UNSAL, T. et al. Assessment of 2, 2-Dibromo-3-Nitrilopropionamide Biocide Enhanced by D-Tyrosine against Zinc Corrosion by a Sulfate Reducing Bacterium. Industrial & Engineering Chemistry Research, v. 60, n. 10, p. 4009–4018, 2021.
VIKRAM, A.; BOMBERGER, J. M.; BIBBY, K. J. Efflux as a glutaraldehyde resistance mechanism in Pseudomonas fluorescens and Pseudomonas aeruginosa biofilms. Antimicrobial Agents and Chemotherapy, 2015.
WADE, S. A. et al. The role of standards in biofilm research and industry innovation. International Biodeterioration & Biodegradation, v. 177, p. 105532, 2023. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0964830522001603>.
WANG, D. et al. Mitigation of carbon steel biocorrosion using a green biocide enhanced by a nature-mimicking anti-biofilm peptide in a flow loop. Bioresources and Bioprocessing, v. 9, n. 1, p. 67, 2022. Disponível em: <https://doi.org/10.1186/s40643-022-00553-z>.
WILLIAMS, T. M.; MCGINLEY, H. R. Deactivation of industrial water treatment biocides. In: CORROSION 2010, Anais…OnePetro, 2010.
XU, D. et al. D-amino acids for the enhancement of a binary biocide cocktail consisting of THPS and EDDS against an SRB biofilm. World Journal of Microbiology and Biotechnology, v. 28, n. 4, p. 1641–1646, 2012.
XU, D.; LI, Y.; GU, T. Mechanistic modeling of biocorrosion caused by biofilms of sulfate reducing bacteria and acid producing bacteria. Bioelectrochemistry, 2016.
XU, L. et al. Inadequate dosing of THPS treatment increases microbially influenced corrosion of pipeline steel by inducing biofilm growth of Desulfovibrio hontreensis SY-21. Bioelectrochemistry, p. 108048, 2022. Disponível em: <https://www.sciencedirect.com/science/article/pii/S156753942100311X>.
YULI, I.; TZAFRIR, I.; SALAMA, P. Compatibility Investigation of Cationic Surfactants with Anionic Species. Cosmetics, v. 10, n. 2, p. 45, 2023.
___________________________________________________

___________________________________________________






